Bảng Tuần Hoàn Hoá Học Lớp 7 Lớp 8 Lớp 9 Lớp 10 Full HD Bản Mới Chuẩn Bộ Giáo Dục
Dường như từ khi Dmitri Mendeleev lần đầu tiên sắp xếp các nguyên tố hóa học vào một bảng dạng tuần hoàn vào năm 1869, bảng tuần hoàn các nguyên tố đã trở thành một biểu tượng vĩ đại của sự hiểu biết về cấu trúc và tính chất của vũ trụ.
Trước tiên, mình rất cảm ơn nếu bạn click vào ảnh MÃ GIẢM GIÁ Shopee dưới đây, Bạn có thể lưu mã hoặc không lưu mã, mua hàng hoặc không mua hàng. Cảm ơn bạn!

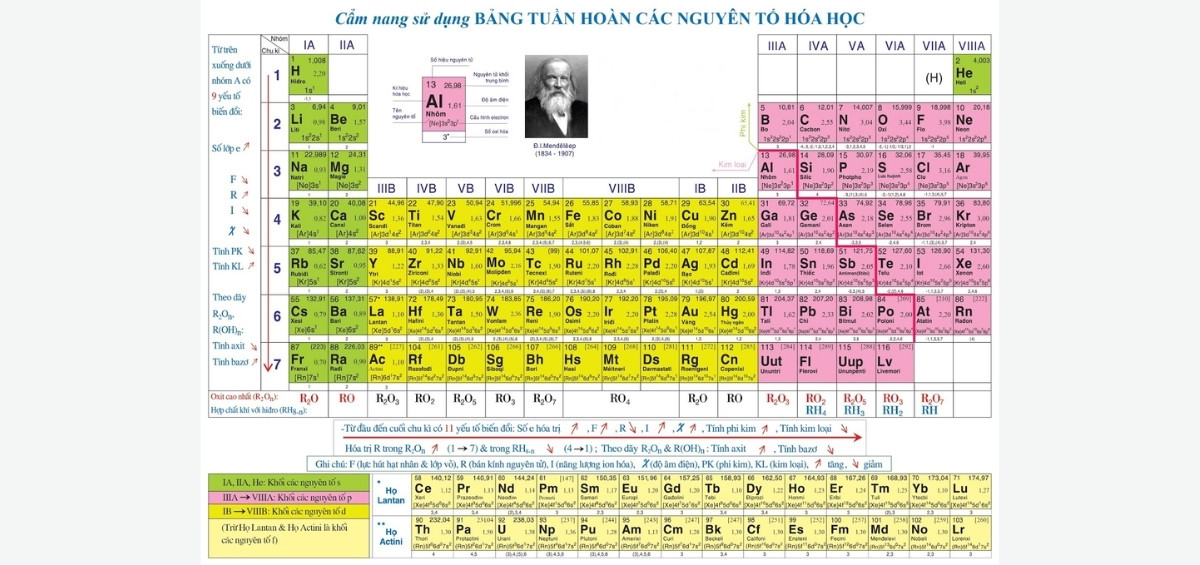
Bảng tuần hoàn hóa học full HD
Mua Ngay Bảng tuần hoàn Hóa Học – Được Bộ GD&ĐT cho phép mang vào phòng thi
Bảng tuần hoàn hoá học là gì?
Khái niệm
Bảng tuần hoàn các nguyên tố hóa học hay còn có tên gọi khác là bảng tuần hoàn Mendeleev. Thực chất đây là cách tổ chức các nguyên tố theo thứ tự tăng dần của số hiệu nguyên tử. Nó giúp phản ánh các mẫu lặp lại và tính chất tuần hoàn của các nguyên tố.
Bảng tuần hoàn hóa học thường có 18 cột và 7 dòng. Theo đó, các nguyên tố sẽ được sắp xếp theo nhóm và chu kỳ. Sự sắp xếp này giúp dễ dàng nhận biết các quy luật và tính chất hóa học của các nguyên tố.
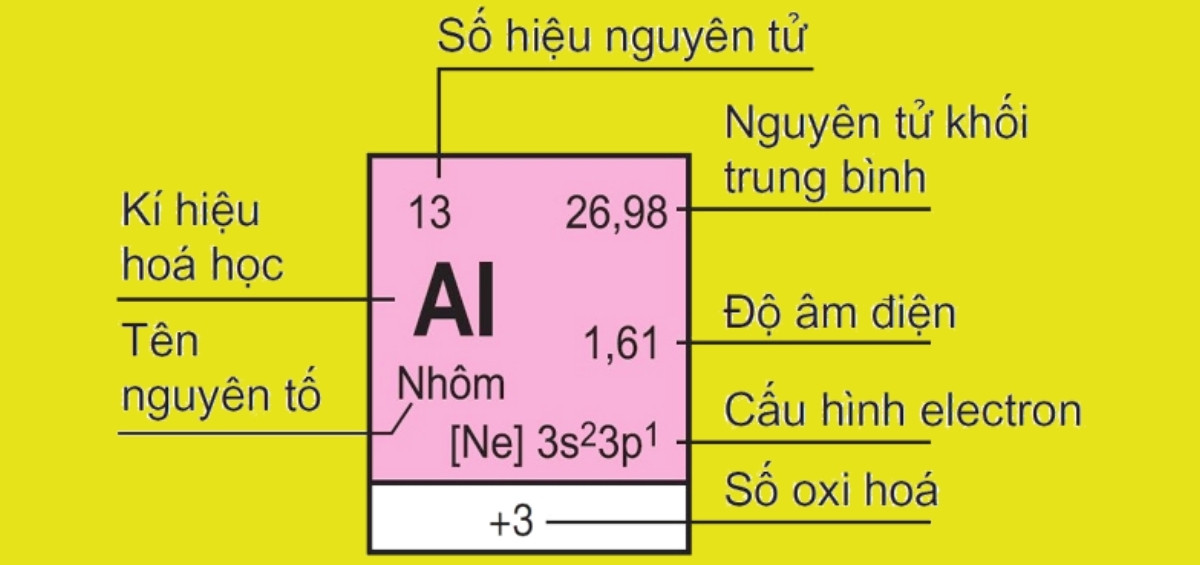
Lịch sử bảng tuần hoàn hoá học
Lịch sử của bảng tuần hoàn hóa học bắt đầu từ giai đoạn sơ khai. Tức vào thế kỷ XVII và thế kỷ XIX, khi các nhà khoa học bắt đầu khám phá các nguyên tố hóa học mà không có cách nào để sắp xếp chúng theo một cấu trúc hệ thống.
Thế kỷ XIX là giai đoạn quan trọng khi các nhà khoa học như John Dalton (1829) và John Newlands (1862) đưa ra các mô hình, ý tưởng về nguyên tử và việc sắp xếp nguyên tố hóa học. Tuy nhiên, những ý tưởng này không thể giải thích hết các tính chất của các nguyên tố.
Theo đó, Julius Lothar Meyer (1864) đã phát hiện mối quan hệ giữa khối lượng nguyên tử và tính chất hóa học của các nguyên tố. Chính điều này đã mở ra cơ sở cho việc phát triển bảng tuần hoàn.
Giai đoạn 2 của lịch sử này chứng kiến sự xuất hiện của Dmitri Mendeleev và Lothar Meyer với các phiên bản sơ khai của bảng tuần hoàn dựa trên cấu trúc hóa học của các nguyên tố. Mendeleev (1869) đã xây dựng bảng tuần hoàn dựa trên sự sắp xếp các nguyên tố theo khối lượng nguyên tử và các tính chất hóa học tương tự của chúng. Ông đã dự đoán và đặt tên cho nhiều nguyên tố chưa được phát hiện.
Henry Moseley (1913) đã đề xuất bảng tuần hoàn dựa trên số hiệu nguyên tử, không phải khối lượng nguyên tử. Đây là người có ảnh hưởng mạnh mẽ tạo nên bảng tuần hoàn hiện đại đầu tiên.
Giai đoạn 3 là giai đoạn sau khi bảng tuần hoàn được chấp nhận và tiếp tục được nghiên cứu và phát triển. Các nhà khoa học đã dùng bảng này để dự đoán và nghiên cứu về tính chất của các nguyên tố. Điều này đóng góp cho sự tiến bộ trong nhiều lĩnh vực khoa học từ thập kỷ 1910 đến nay.
Vai trò và ý nghĩa của bảng tuần hoàn các nguyên tố
Sự ra đời của bảng tuần hoàn các nguyên tố có vai trò và ý nghĩa quan trọng. Nó giúp tổ chức các nguyên tố hóa học theo một cách dễ hiểu nhất.
Dưới đây là những vai trò và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học mang lại:
Tổ chức và phân loại
Bảng tuần hoàn các nguyên tố là bảng giúp tổ chức và phân loại các nguyên tố theo trật tự rõ ràng. Theo đó, các nguyên tố sẽ được sắp xếp theo thứ tự số hiệu nguyên tử tăng dần.
Dễ dàng tìm kiếm thông tin
Thông qua bảng tuần hoàn các nguyên tố, bạn có thể dễ dàng tìm kiếm thông tin về bất kỳ một nguyên tố hóa học nào. Mỗi ô trong bảng sẽ có đầy đủ các thông tin về nguyên tố đó. Cụ thể là ký hiệu hóa học, tên nguyên tố, số hiệu nguyên tử và khối lượng nguyên tử.
Dự đoán tính chát
Bảng tuần hoàn hóa học có thể giúp bạn dự đoán được tính chất của các nguyên tố hóa học. Ví dụ, các nguyên tố trong cùng một nhóm thường có tính chất hóa học tương đồng với nhau.
Hỗ trợ cho việc học tập và nghiên cứu
Bảng tuần hoàn hóa học ra đời là công cụ hữu ích cho học sinh, nhà khoa học. Thông qua đó, họ có thể nghiên cứu cũng như tìm hiểu các thông tin về nguyên tố khác nhau. Nó cũng giúp cho mọi người có thể hiểu rõ cấu trúc cũng như tính chất của các nguyên tố.
Cấu tạo bảng tuần hoàn các nguyên tố hoá học
Bảng tuần hoàn các nguyên tố hóa học có cấu tạo đơn giản và dễ hiểu. Dưới đây là nội dung chi tiết:
Cấu trúc: Chu kỳ, nhóm, khối và ô
Bảng tuần hoàn các nguyên tố hóa học có cấu trúc bao gồm chu kỳ, nhóm, khối và ô. Cấu trúc này giúp việc tìm hiểu các nguyên tố hóa học có tổ chức, dễ hiểu.
Chu kỳ: Bảng tuần hoàn được chia thành các chu kỳ, mỗi chu kỳ là một dãy ngang trên bảng. Mỗi chu kỳ bắt đầu từ một nguyên tố có tính chất tương tự và kết thúc khi bắt đầu một chu kỳ mới. Có tổng cộng 7 chu kỳ trên bảng tuần hoàn.
Nhóm: Các nguyên tố hóa học được tổ chức thành các nhóm dọc theo bảng. Mỗi nhóm chứa các nguyên tố có tính chất hóa học tương tự nhau. Có tổng cộng 18 nhóm trên bảng tuần hoàn.
Khối: Bên cạnh việc chia thành các chu kỳ và nhóm, bảng tuần hoàn còn được chia thành các khối. Các khối thường được phân biệt bởi các màu sắc khác nhau để dễ dàng nhận biết. Các khối bao gồm:
- Khối s (màu đỏ hoặc hồng)
- Khối p (màu xanh lá cây)
- Khối d (màu xanh dương)
- Khối f (màu vàng hoặc hồng nhạt)
Ô: Mỗi ô trong bảng tuần hoàn chứa thông tin về một nguyên tố hóa học cụ thể. Thông tin này bao gồm:
Ký hiệu hóa học: Một biểu tượng hoặc ký hiệu viết tắt đại diện cho nguyên tố.
Tên nguyên tố: Tên đầy đủ của nguyên tố hóa học.
Số hiệu nguyên tử: Số proton trong hạt nhân của nguyên tố, cũng là số thứ tự của nguyên tố trong bảng tuần hoàn.
Khối lượng nguyên tử: Trọng lượng trung bình của nguyên tử của nguyên tố, được tính bằng đơn vị độ khối (amu).

Mua Ngay Bảng tuần hoàn Mới – Được Bộ GD&ĐT cho phép mang vào phòng thi
Phân loại nguyên tố: Kim loại, Phi kim, Á kim
Các nguyên tố trong bảng tuần hoàn hóa học sẽ bao gồm ba nhóm chính. Đó là kim loại, phi kim và á kim.
Kim loại
Đặc điểm: Nhóm nguyên tố hóa học thuộc kim loại sẽ có tính chất chung là tính dẻo, tính dẫn điện và dẫn nhiệt tốt. Hầu hết các kim loại là rắn ở nhiệt độ trong phòng và chúng có bề mặt sáng bóng.
Vị trí trên bảng tuần hoàn các nguyên tố hóa học: Kim loại chủ yếu tập trung ở bên trái của bảng tuần hoàn, bao gồm các nhóm 1 đến 12.
Ví dụ kim loại: Những kim loại phổ biến bao gồm như sắt, đồng, nhôm, kẽm, vàng và bạc.
Phi kim
Đặc điểm chung: Phi kim là nhóm các nguyên tố không có tính chất của kim loại. Chúng thường có tính chất kháng điện và kháng nhiệt tốt.
Vị trí trên bảng tuần hoàn các nguyên tố hóa học: Phi kim chủ yếu nằm ở bên phải của bảng tuần hoàn, bao gồm các nhóm 13 đến 18.
Ví dụ: Các phi kim phổ biến bao gồm như cacbon, silic, nitơ, oxy, và flor.
Á kim
Đặc điểm chung: Á kim là nhóm các nguyên tố có tính chất trung gian giữa kim loại và phi kim. Chúng có thể có tính chất của cả hai loại nguyên tố.
Vị trí trên bảng tuần hoàn các nguyên tố hóa học: Á kim nằm ở phía giữa của bảng tuần hoàn, đặc biệt là ở nhóm 3 đến 12.
Ví dụ: Một số nguyên tố trong nhóm này là kim loại chuyển tiếp, bao gồm như titan, sắt, nickel và đồng.
Những thuật ngữ cần biết khi đọc bảng tuần hoàn
Để có thể dễ dàng đọc bảng tuần hoàn thì bạn cần lưu ý những thuật ngữ dưới đây:
Nguyên tố
Nguyên tố là những chất cơ bản không thể phân chia thành các chất khác thông qua các phản ứng hóa học. Mỗi nguyên tố được xác định bởi số proton trong hạt nhân của nó, gọi là số nguyên tử. Các nguyên tố khác nhau có số nguyên tử khác nhau, do đó tạo ra tính đặc trưng riêng biệt cho mỗi nguyên tố.
Dưới đây là một số thông tin cơ bản về nguyên tố:
Số nguyên tử: Là số proton trong hạt nhân của nguyên tố, xác định tính chất cơ bản của nguyên tố. Ví dụ, nguyên tố Hidro có số nguyên tử là 1 vì có một proton trong hạt nhân của nó.
Ký hiệu hóa học: Là biểu tượng hoặc ký hiệu đại diện cho mỗi nguyên tố. Ví dụ, ký hiệu hóa học của Hydro là “H”.
Tên nguyên tố: Là tên đầy đủ của mỗi nguyên tố. Ví dụ, tên đầy đủ của nguyên tố có ký hiệu “H” là Hydrogen.
Tính chất hóa học và vật lý: Mỗi nguyên tố có các tính chất hóa học và vật lý riêng biệt, bao gồm màu sắc, trạng thái (rắn, lỏng, khí), khối lượng nguyên tử, điểm nóng chảy và điểm sôi.
Phân loại: Các nguyên tố được phân loại thành các nhóm như kim loại, phi kim và á kim dựa trên tính chất hóa học và vật lý của chúng.
Ứng dụng: Các nguyên tố được sử dụng rộng rãi trong nhiều lĩnh vực, bao gồm công nghiệp, y tế, năng lượng, vật liệu xây dựng, điện tử và nhiều lĩnh vực khác. Ví dụ, sắt được sử dụng để làm các công cụ và cấu trúc xây dựng, trong khi oxit nhôm được sử dụng làm chất chống cháy trong vật liệu xây dựng.
Số hiệu nguyên tử
Số hiệu nguyên tử còn được gọi là số proton. Số hiệu nguyên tử là số lượng proton được tìm thấy trong hạt nhân của một nguyên tử. Nó được ký hiệu bằng chữ Z. Từ này xuất phát từ tiếng Đức “Zahl”, có nghĩa là số.
Ban đầu, Z chỉ đơn giản là vị trí của một nguyên tố trong bảng tuần hoàn hóa học nhưng sau này nghiên cứu cho thấy rằng Z cũng đồng nghĩa với điện tích của hạt nhân và đặc tính vật lý của nguyên tử. Trong một nguyên tử ổn định, số proton (Z) bằng số electron.
Ví dụ:
Trong nguyên tử của Hidro, số hiệu nguyên tử là 1 vì trong hạt nhân của nó chỉ có một proton. Tương tự, trong nguyên tử của Cacbon, số hiệu nguyên tử là 6 do có sáu proton trong hạt nhân của nó. Đối với Uranium, nguyên tử có số hiệu nguyên tử là 92 bởi vì hạt nhân của nó chứa 92 proton. Do đó, qua số hiệu nguyên tử, chúng ta có thể nhận biết và phân biệt giữa các nguyên tố hóa học khác nhau.
Ký hiệu hoá học
Ký hiệu hóa học là một biểu tượng hoặc ký tự được sử dụng để đại diện cho mỗi nguyên tố hóa học. Mỗi nguyên tố hóa học được đại diện bằng một ký hiệu duy nhất để dễ dàng nhận biết và sử dụng trong các phản ứng hoá học và các công thức hóa học.
Các ký hiệu hoá học thường được tạo ra từ một hoặc hai chữ cái của tên tiếng Anh của nguyên tố. Đôi khi ký hiệu này còn kèm theo một hoặc hai chữ số. Ví dụ: Ký hiệu hoá học của Hydro là “H”, của Oxi là “O” và của Cacbon là “C”.
Đôi khi, các nguyên tố có cùng chữ cái đầu tiên. Vì vậy ký hiệu hoá học thường được lấy từ chữ cái đầu tiên của tên tiếng Anh, kết hợp với một chữ cái khác hoặc một số đặc biệt để phân biệt. Ví dụ: Ký hiệu hoá học của Nitrogen là “N”, trong khi của Nickel là “Ni”.
Ký hiệu hoá học mang ý nghĩa quan trọng trong hóa học vì chúng giúp giảm bớt sự phức tạp khi viết các công thức hóa học và phản ứng hóa học. Thông qua ký hiệu hoá học cũng giúp chúng ta dễ dàng nhận biết và phân loại các nguyên tố khác nhau.
Khối lượng nguyên tử
Khối lượng nguyên tử là khối lượng trung bình của một nguyên tử của một nguyên tố. Khối lượng nguyên tử được đo bằng đơn vị gọi là “đơn vị khối nguyên tử” (amu). Nó phản ánh tổng khối lượng của proton và neutron trong hạt nhân của nguyên tử.
Ví dụ: Khối lượng nguyên tử của Carbon là khoảng 12 am, vì nó có 6 proton và khoảng 6 neutron trong hạt nhân.
Khối lượng nguyên tử là một đặc điểm quan trọng giúp chúng ta hiểu và dự đoán tính chất của các nguyên tố và phản ứng hóa học.
Điện tích hạt nhân
Điện tích hạt nhân là điện tích dương tập trung ở trung tâm của mỗi nguyên tử. Nó là tổng điện tích của tất cả proton trong hạt nhân. Điện tích này chịu trách nhiệm duy trì sự liên kết của electron xung quanh hạt nhân.
Điện tích hạt nhân quyết định tính phân bố của electron và do đó ảnh hưởng đến tính chất hoá học của mỗi nguyên tố. Số proton trong hạt nhân cũng chính là số nguyên tử, được ký hiệu là Z và quyết định số hiệu nguyên tử của nguyên tố.
Ví dụ: Nguyên tử Hidro có một proton trong hạt nhân, do đó có điện tích hạt nhân dương duy nhất. Trong khi đó, nguyên tử của Heli có hai proton trong hạt nhân nên có điện tích hạt nhân dương lớn hơn so với Hidro.
Sự khác biệt về điện tích hạt nhân giữa các nguyên tố sẽ ảnh hưởng đến cách mà các nguyên tử tương tác với nhau trong các phản ứng hóa học.
Bán kính nguyên tử
Bán kính nguyên tử là khoảng cách trung bình giữa hai hạt nhân nguyên tử gần nhau nhất trong chất rắn đơn chất hoặc trong phân tử hai nguyên tử giống nhau. Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân và các electron ở lớp ngoài cùng. Khi lực hút tăng, bán kính giảm và ngược lại.
Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân. Điều này xảy ra vì khi điện tích hạt nhân tăng, lực hút của hạt nhân lên electron lớp ngoài cùng cũng tăng, dẫn đến việc bán kính giảm.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân. Điều này xảy ra vì khi điện tích hạt nhân tăng, số lớp electron cũng tăng, làm cho bán kính nguyên tử tăng.
Năng lượng ion hoá
Năng lượng ion hóa là năng lượng cần thiết để loại bỏ một electron từ một nguyên tử hoặc một ion để tạo ra một ion dương. Tính chất của năng lượng ion hóa phụ thuộc vào cấu trúc electron của nguyên tử và ion đó.
Trong bảng tuần hoàn hóa học, năng lượng ion hóa thường tăng khi di chuyển từ trái sang phải và giảm khi di chuyển từ trên xuống dưới. Điều này phản ánh sự tăng giảm của điện tích hạt nhân và hiệu ứng liên kết. Năng lượng ion hóa có thể chia thành nhiều cấp độ khác nhau tùy thuộc vào việc loại bỏ electron đầu tiên, thứ hai, thứ b, và cứ tiếp tục như vậy.
Các phương pháp thí nghiệm và tính toán được sử dụng để xác định năng lượng ion hóa giúp chúng ta hiểu rõ hơn về cách mà các nguyên tử tương tác và phản ứng trong hoá học.
Độ âm điện
Độ âm điện là khả năng của một nguyên tử thu hút electron về phía nó trong liên kết hóa học. Nó được đo lường bằng nhiều cách khác nhau, trong đó thang đo phổ biến nhất là thang đo Pauling. Các nguyên tử có độ âm điện khác nhau dựa trên kích thước và số proton, neutron và electron.
Độ âm điện thường được biểu diễn trên biểu đồ độ âm điện, nơi có thể dễ dàng nhìn thấy xu hướng và giá trị. Độ âm điện cao hơn cho thấy nguyên tử càng thu hút các electron. Xu hướng độ âm điện trong bảng tuần hoàn thể hiện rằng từ trái sang phải, độ âm điện tăng dần.
Tuy nhiên, từ trên xuống dưới, độ âm điện giảm dần do kích thước nguyên tử tăng. Độ âm điện quan trọng vì nó giúp dự đoán cách các nguyên tố sẽ liên kết với nhau và loại liên kết nào sẽ hình thành.
Hoá trị
“Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác. Hóa trị của một nguyên tố được xác định theo hóa trị của H chọn làm đơn vị và hóa trị của O là hai đơn vị”. (Theo Sách giáo khoa Hóa học 8 – NXB giáo dục Việt Nam).
Ví dụ: Oxi cần hai electron để đạt được cấu hình electron của khí noble gần nhất. Vì vậy, hoá trị của oxi thường là -2, vì nó có thể dễ dàng nhận hai electron này. Tuy nhiên, đôi khi hoá trị có thể thay đổi tùy thuộc vào điều kiện phản ứng. Ví dụ, sắt có thể có hoá trị +2 hoặc +3 trong các hợp chất khác nhau.
Việc hiểu hoá trị rất quan trọng trong hóa học vì nó giúp chúng ta dự đoán cách các nguyên tử sẽ tương tác với nhau trong các phản ứng hóa học. Điều này giúp chúng ta hiểu về tính chất của các chất và cách chúng có thể được sử dụng trong các ứng dụng khác nhau, từ sản xuất hóa chất đến y học.
Ngoài ra, khi đọc bảng tuần hoàn hoá học bạn sẽ còn dễ dàng bắt gặp một số thuật ngữ khác như đồng vị, phân tử, hợp chất,..
Đồng vị là các biến thể của cùng một nguyên tố, chúng có cùng số proton nhưng khác số neutron. Ví dụ: Ba đồng vị ổn định nhất của hidro: proti (A = 1), deuteri (A = 2), và triti (A = 3).
Phân tử là các cấu trúc được tạo thành từ việc kết hợp của hai hoặc nhiều nguyên tử thông qua các liên kết hóa học. Ví dụ, phân tử nước (H₂O) bao gồm hai nguyên tử hidro (H) và một nguyên tử oxi (O) được kết hợp với nhau bằng liên kết hóa học.
Hợp chất là các chất được tạo thành từ sự kết hợp của hai hoặc nhiều nguyên tố khác nhau trong tỉ lệ nhất định thông qua các phản ứng hóa học. Ví dụ, nước (H₂O) là một hợp chất, với hai nguyên tử hidro và một nguyên tử oxi liên kết với nhau theo tỉ lệ 2:1.
Nguyên tắc sắp xếp trong bảng tuần hoàn
Bảng tuần hoàn các nguyên tố là một cấu trúc tổ chức có thứ tự giúp chúng ta hiểu và dự đoán tính chất của các nguyên tố hóa học. Các nguyên tắc sắp xếp trong bảng tuần hoàn giúp cho việc này trở nên rõ ràng và dễ dàng hơn.
Dưới đây là 3 nguyên tắc sắp xếp trong bảng tuần hoàn mà bạn cần biết:
Nguyên tắc 1: Sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
Nguyên tắc 1 cho biết rằng các nguyên tố hoá học được sắp xếp theo thứ tự tăng dần của số proton trong hạt nhân nguyên tử. Hay còn gọi là số nguyên tử hoặc số hiệu nguyên tử. Theo nguyên tắc này thì từ bên trái sang phải của bảng tuần hoàn các nguyên tố hoá học, số nguyên tử của các nguyên tố sẽ tăng dần.
Nguyên tắc 2: Sắp xếp theo số lớp electron
Các nguyên tố có cùng số lớp electron hay cùng mức năng lượng trong nguyên tử sẽ được sắp xếp thành một hàng trên bảng tuần hoàn. Khi đi từ trái sang phải trên hàng, số lượng proton trong hạt nhân và electron trong các lớp electron tăng dần.
Nguyên tố 3: Sắp xếp theo số lớp electron hoá trị
Các nguyên tố hoá học có cùng số lớp electron hoá trị hay cùng số electron ở lớp ngoài cùng trong nguyên tử sẽ được sắp xếp thành một cột dọc trong bảng tuần hoàn. Các số electron hoá trị càng tăng dần khi đi từ trên xuống dưới cột.

Ứng dụng của bảng tuần hoàn các nguyên tố hoá học
Bảng tuần hoàn các nguyên tố hoá học có tính ứng dụng rộng rãi ở đa dạng các lĩnh vực.
Dự đoán tính chất của các nguyên tố và hợp chất
Bảng tuần hoàn cung cấp thông tin về cấu trúc nguyên tử và các tính chất của các nguyên tố. Từ vị trí của một nguyên tố trên bảng tuần hoàn, chúng ta có thể dự đoán các tính chất như khối lượng nguyên tử, bán kính nguyên tử, tính chất vật lý (như điểm nóng chảy, điểm sôi) và tính chất hóa học (như khả năng tạo liên kết hóa học, tính acid-base).
Ngoài ra, thông qua vị trí của các nguyên tố trên bảng tuần hoàn, chúng ta có thể dự đoán các tính chất của các hợp chất được hình thành từ các nguyên tố đó.
Ví dụ: Các nguyên tố trong cùng một nhóm thường có các tính chất tương tự nhau, do đó các hợp chất hình thành từ chúng cũng có tính chất tương đương.
Giải thích các phản ứng hóa học
Bảng tuần hoàn giúp chúng ta hiểu được tại sao các nguyên tố phản ứng với nhau như thế nào. Bằng cách phân tích cấu trúc nguyên tử và tính chất hóa học của các nguyên tố, chúng ta có thể giải thích các phản ứng hóa học diễn ra như thế nào, bao gồm cả quá trình tạo ra và phân giải hợp chất.
Phân loại các hợp chất hóa học
Bảng tuần hoàn cho phép chúng ta phân loại các hợp chất dựa trên cấu trúc và tính chất của chúng. Bằng cách sắp xếp các nguyên tố theo nhóm và chu kỳ, chúng ta có thể dễ dàng phân biệt và nhận dạng các loại hợp chất. Từ đó, thông qua bảng tuần hoàn các nguyên tố hoá học chúng ta sẽ hiểu rõ hơn về tính chất của chúng và cách chúng tương tác trong các phản ứng hóa học.
Nghiên cứu các nguyên tố mới
Bảng tuần hoàn là một công cụ hữu ích cho việc dự đoán và tìm kiếm các nguyên tố mới. Bằng cách xem xét các “lỗ trống” trên bảng tuần hoàn và áp dụng các mô hình và quy luật của hoá học, các nhà khoa học có thể dự đoán được tính chất của các nguyên tố chưa được phát hiện.
Qua đó, học cũng có thể đề xuất các phương pháp để tìm kiếm chúng trong các phản ứng hạt nhân hoặc thí nghiệm hóa học.
Ứng dụng trong các lĩnh vực khác
Bên cạnh đó, bảng tuần hoàn hoá học còn được ứng dụng trong nhiều lĩnh vực khác, cụ thể như:
Trong vật lý: Bảng tuần hoàn cung cấp thông tin về các tính chất vật lý của các nguyên tố như khối lượng nguyên tử, bán kính nguyên tử và năng lượng ion hóa. Các thông tin này có thể được sử dụng để nghiên cứu và dự đoán tính chất vật lý của vật liệu và các hệ thống vật lý khác.
Trong sinh học: Bảng tuần hoàn giúp trong việc hiểu về sự phân bố và vai trò của các nguyên tố trong cơ thể cũng như trong quá trình phát triển và chức năng của các hệ thống sinh học.
Trong địa chất: Bảng tuần hoàn được sử dụng để nghiên cứu sự phân bố và tính chất của các nguyên tố trong vỏ trái đất cũng như trong quá trình hình thành và phát triển của các khoáng sản và đá.
Trong môi trường: Các thông tin về các nguyên tố trên bảng tuần hoàn giúp trong việc đánh giá và dự đoán tác động của các chất gây ô nhiễm hoặc nguy cơ đối với môi trường và sức khỏe con người.
Trong khoa học vật liệu: Thông tin từ bảng tuần hoàn giúp chọn nguyên tố phù hợp, thiết kế vật liệu mới và nghiên cứu tính chất của chúng để cải thiện hiệu suất và ứng dụng trong các ngành công nghiệp khác nhau.
Một số tranh luận xung quanh bảng tuần hoàn
Bảng tuần hoàn các nguyên tố hoá học được xem là một trong những thành tựu vĩ đại nhất trong hoá học. Mặc dù vậy, nó vẫn tồn tại nhiều tranh luận. Các tranh luận này mang đến sự thách thức lớn đối với cộng đồng khoa học nghiên cứu về lĩnh vực này.
Ví dụ một số tranh cãi điển hình:
Tranh cãi 1: BTHH không hoàn toàn hoàn chỉnh
Mặc dù bảng tuần hoàn các nguyên tố đã trở thành một công cụ cực kỳ hữu ích và quan trọng trong lĩnh vực hóa học nhưng vẫn tồn tại một số hạn chế và không hoàn toàn hoàn chỉnh. Dưới đây là một số điểm chi tiết liên quan đến vấn đề này:
Bảng tuần hoàn hiện đại đã ghi chép tất cả các nguyên tố từ hidro đến ununoctium (118) nhưng vẫn còn một số nguyên tố chưa được phát hiện hoặc xác định.
Một số nguyên tố trên bảng tuần hoàn không phải là nguyên tố tự nhiên mà là sản phẩm của quá trình tổng hợp nhân tạo hoặc là tạp chất của các quá trình tự nhiên khác.
Các nguyên tố có số nguyên tử lớn hơn ununoctium (118) vẫn chưa được tạo ra hoặc xác định một cách chắc chắn do tính không ổn định và thời gian tồn tại ngắn.

Tranh cãi 2: Một số nguyên tố có vị trí chưa được sắp xếp hợp lý
Tranh cãi xảy ra về sự chính xác của việc áp dụng luật hậu tứ bảo hoá để sắp xếp các nguyên tố trong bảng tuần hoàn. Có những ngoại lệ và không đồng nhất trong việc áp dụng luật này cho tất cả các nguyên tố.
Câu hỏi lớn là liệu nên đặt Hidro ở đầu hoặc cuối của bảng tuần hoàn hoặc đặt nó cạnh các nguyên tố của nhóm 1. Sự đồng thuận về vị trí của Hidro vẫn chưa được đạt được.
Tranh cãi về cách sắp xếp các nguyên tố trong nhóm 3 như boron, nhôm, gallium, indium, thallium. Có đề xuất để đặt chúng vào một nhóm riêng biệt hoặc đặt bên dưới nhóm 13.
Bên cạnh hai vấn đề lớn trên thì xung quanh bảng tuần hoàn hoá học cũng còn nhiều điều gây tranh cãi. Những tranh cãi này trở thành chủ đề quan tâm của nhiều nhà khoa học để tập trung cải tiến nội dung hoàn chỉnh nhất.
Một số câu hỏi nhanh về Bảng Tuần Hoàn
Bảng tuần hoàn hóa học lớp 10 trang bao nhiêu?
Bảng tuần hoàn hóa học lớp 10 trang 36, bài 7 sách giáo khoa Hoá học. Bảng tuần hoàn này giúp các bạn học sinh có thể theo dõi các nội dung bao gồm các thông tin về số nguyên tử, khối lượng nguyên tử, ký hiệu nguyên tố và nhiều thông tin khác về tính chất hóa học của từng nguyên tố. Việc hiểu và sử dụng bảng tuần hoàn này là rất quan trọng trong việc nắm vững kiến thức cơ bản về hóa học.
Bảng tuần hoàn các nguyên tố hóa học có bao nhiêu nguyên tố?
Bảng tuần hoàn các nguyên tố hóa học hiện nay có tổng cộng 118 nguyên tố. Tuy nhiên, chỉ có 118 nguyên tố này được phát hiện và xác định một cách chắc chắn và được chấp nhận rộng rãi trong cộng đồng khoa học.
Hàng ngang trong bảng tuần hoàn các nguyên tố hóa học còn gọi là gì?
Hàng ngang trong bảng tuần hoàn các nguyên tố hóa học còn được gọi là chu kỳ hoặc nhóm. Trong bảng tuần hoàn hoá học có tổng cộng 7 hàng ngang. Theo đó, mỗi hàng ngang tương ứng với một chu kỳ, được đánh số từ 1 đến 7. Các nguyên tố trong cùng một hàng ngang thường có cùng số lớp electron, dẫn đến các tính chất hóa học và vật lý tương đối tương đồng.
Bảng tuần hoàn hóa học đầu tiên có bao nhiêu nguyên tố?
Bảng tuần hoàn hóa học đầu tiên chỉ có 2 nguyên tố. Đó là Hidro(H) và Heli (He). Đây là hai nguyên tố đơn giản nhất và là hai nguyên tố đầu tiên được xác định trong bảng tuần hoàn hóa học.
Trong bảng tuần hoàn các nguyên tố hóa học có bao nhiêu chu kỳ?
Trong bảng tuần hoàn các nguyên tố hóa học có 7 chu kỳ. Mỗi chu kỳ tương ứng với một hàng ngang trong bảng tuần hoàn và bắt đầu từ nguyên tố Hidro (H) ở chu kỳ 1 và kết thúc ở nguyên tố Ogane Son (Og) ở chu kỳ 7.